Boa tarde galera, segue em anexo um vídeo sobre tabela periódica:
Tabela Periódica
quinta-feira, 1 de agosto de 2013
Modelos Atômicos
Boa tarde galera, segue em anexo alguns vídeos para ajudar no estudo sobre os modelos atômicos.
Modelos Atômicos Parte I
Modelos Atômicos Parte I
Estes vídeos são bem explicativos, espero que auxilie nos estudos, qualquer dúvida só comentar.
Abraços.
segunda-feira, 22 de julho de 2013
Definição de algumas grandezas químicas
Conceito de Grandeza
Grandeza pode ser definido com tudo aquilo que pode ser medido, como por exemplo:
tempo → segundos, minutos, horas, dias, etc.
volume → litros, metros cúbicos, mililitros, etc.
massa → gramas, toneladas, quilogramas, etc.
A medida de uma grandeza é feita por comparação com uma grandeza padrão convenientemente escolhida. Desta forma, a medida de massa de um corpo é feita comparando-se a massa de um determinado corpo com a massa de um padrão adequadamente escolhido.
Quando se diz que uma determinada pessoa possui uma massa de 65 kg, podemos interpretar este resultado como da seguinte maneira: a pessoa possui uma massa 65 vezes maior do que o padrão utilizado para medir a sua massa, ou seja, 1 kg.
Dependendo da quantidade de matéria utilizamos uma determinada grandeza para medir a sua massa.
| Matéria | Grandeza utilizada para medir a massa |
| comprimido | mg |
| pessoa | Kg |
| automóvel | ton |
UNIDADE DE MASSA ATÔMICA (U)
Átomos individuais são muito pequenos para serem vistos e muito menos pesados. Porém, é possível determinar as massas relativas de átomos diferentes, quer dizer, podemos determinar a massa de um átomo comparando com um átomo de outro elemento utilizado como padrão.
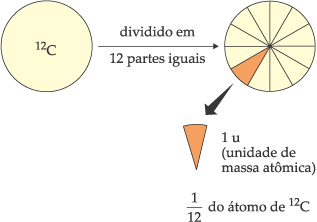
Em 1961, na Conferência da União Internacional de Química Pura e Aplicada (IUPAC), adotou-se como padrão de massas atômicas o isótopo 12 do elemento carbono (12C), ao qual se convencionou atribuir o valor exato de 12 unidades de massa atômica.
Uma unidade de massa atômica (1 u) corresponde desta forma a 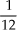 de massa de um átomo de isótopo 12 do carbono.
de massa de um átomo de isótopo 12 do carbono.
Portanto:
Massa Atômica (MA)
Massa atômica é o número que indica quantas vezes a massa de um átomo de um determinado elemento é maior que 1u, ou seja, 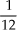 do átomo de 12C.
do átomo de 12C.
Comparando-se a massa de um átomo de um determinado elemento com a unidade de massa atômica (1u), obtém-se a massa desse átomo.
Quando dizemos que a massa atômica do átomo de 32S é igual a 32 u, concluímos que:
– a massa atômica de um átomo de 32S é igual a 32 u;
– a massa atômica de um átomo de 32S é igual a 32 vezes a massa de
– a massa de um átomo de 32S é igual a 2,7 vezes a massa de um átomo de C-12.
Observação
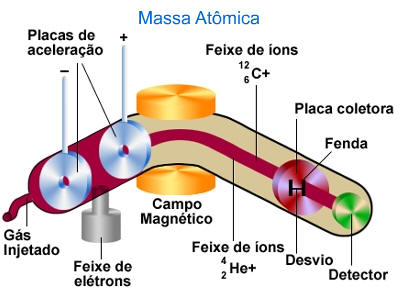
O aparelho utilizado na determinação da massa atômica chama-se espectrômetro de massa. A medida é feita com grande precisão e o processo de determinação da massa do átomo é comparativo com o padrão, ou seja, o átomo de carbono-12.
Massa Atômica de um Elemento
Portanto:
Sendo assim, a massa atômica de um elemento hipotético A, constituído dos isótopos naturais A1, A2, ...., An, pode ser calculada por:
Exemplo
Quando dizemos que a massa atômica do elemento cloro é 35,5 u, concluímos que:
– cada átomo do elemento cloro possui massa, em média, de 35,5 u;
– cada átomo do elemento cloro possui massa, em média, 35,5 vezes maior que 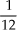 da massa do C-12.
da massa do C-12.
Massa Molecular (MM)
Os átomos reúnem-se para formar moléculas. A massa dessas moléculas é a soma das massas atômicas dos átomos constituintes.
Como as moléculas são formadas por um grupo de átomos ligados entre si, o padrão usado como base para relacionar as massas dessas moléculas é o mesmo usado para os átomos: a unidade de massa atômica (u).
Exemplo:
C6H12O6 (C=12, H=1, O=16)
MM = 6 . 12 + 12 . 1 + 6 . 16
MM = 72 + 12 + 96
MM = 180 u
Significado:
Cada molécula de C6H12O6 possui massa de 180 u, ou seja, 180 vezes maior que 1/12 do carbono-12.
Portanto:
ou ainda...
Vejamos outro exemplo:
Quando dizemos que a massa molecular da água H2O é 18 u, concluímos que:
• a massa de uma molécula H2O é igual a 18 u;
a massa de uma molécula H2O é 18 vezes mais pesada que 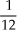 do átomo de carbono-12;
do átomo de carbono-12;
• a massa de uma molécula de água é 1,5 vezes mais pesada que um átomo de C-12.
Constante de Avogadro (N)
Sejam as seguintes amostras: 12 g de carbono, 27 g de alumínio e 40 g de cálcio. Experimentalmente verifica-se que o número de átomos N, existentes em cada uma das amostras, é o mesmo, embora elas possuam massas diferentes. Porém, quantos átomos existem em cada uma dessas amostras? Várias experiências foram realizadas para determinar esse número conhecido como número de Avogadro (N) e o valor encontrado é igual a:
Assim, o número de Avogadro é o número de átomos em x gramas de qualquer elemento, sendo x a massa atômica do elemento, portanto existem:
• 6,02 · 1023 átomos de C em 12 g de C (MAC = 12 u);
• 6,02 · 1023 átomos de Al em 27 g de Al (MAAl = 27 u);
• 6,02 · 1023 átomos de Ca em 40 g de Ca (MACa = 40 u).
Saiba mais sobre.....
Como foi determinado o Número de Avogadro
Rutherford determinou o número de Avogadro contando as partículas α (alfa) emitidas pelo rádio. Cada partícula α se transforma em um átomo de hélio e elas são emitidas com tanta energia que cada uma produz um sinal visível, numa placa de sulfeto de zinco (ZnS). Isso permite contá-las e, portanto, saber quantos átomos de hélio a amostra de rádio produz em um determinado intervalo de tempo.
Rutherford encontrou que 1 g de rádio produz cerca de 7,7 · 10–6 g de hélio em um ano e calculou que, nesse tempo, 1 g de rádio emitiria 11,6 · 1017 partículas α (e, portanto, 11,6 · 1017 átomos de hélio).
Sendo assim ficamos com:
7,7 . 10-6 g de He → 11,6 . 1017 átomos de He
4 g (He) → N
Onde:
N = 6,02 . 1023 átomos
Conceito de Mol
Segundo a União Internacional da Química Pura e Aplicada (IUPAC), mol é a quantidade de matéria que contém tantas entidades elementares quantos são os átomos de carbono-12 contidos em 0,012 kg do C-12.
Constante de Avogadro é o número de átomos de C-12 contidos em 0,012 kg de C-12 e seu valor é
6,02 · 1023mol -1.
Portanto:
Sendo que, por exemplo:
• 1 mol de laranjas contém → 6,02 · 1023 laranjas;
• 1 mol de grãos de areia contém → 6,02 · 1023 grãos de areia;
• 1 mol de átomos contém → 6,02 · 1023 átomos;
• 1 mol de moléculas contém → 6,02 · 1023 moléculas;
• 1 mol de íons contém → 6,02 · 1023 íons;
• 1 mol de elétrons contém → 6,02 · 1023 elétrons, etc.
Massa Molar (M)
Massa Molar de um Elemento
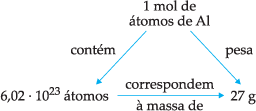
A massa molar de um elemento é a massa em gramas de 1 mol de átomos, ou seja, 6,02 · 1023 átomos desse elemento. A massa molar de um elemento é numericamente igual à sua massa atômica expressa em gramas.
Exemplo:
Al (MA = 27 u)
Massa Molar de uma Substância
A massa molar de uma substância é a massa em gramas de 1 mol de moléculas da referida substância. A massa molar de uma substância é numericamente igual à sua massa molecular expressa em gramas.
Exemplos
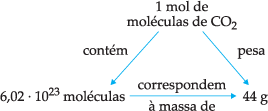
a) CO2 (C = 12 u ; O = 16 u)
MM = 1 · 12 + 2 · 16
MM = 12 + 32 = 44 u
Logo, ficamos com:
b) NaCl (Na = 23; Cl = 35,5)
MM = 1 · 23 + 1 · 35,5
MM = 23 + 35,5 = 58,5 u
Logo, ficamos com:
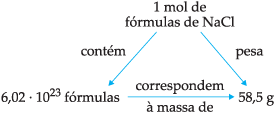
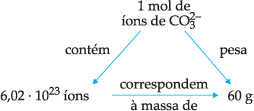
Massa Molar de um Íon
A massa molar de um íon é a massa de 1 mol de íons em gramas que é numericamente igual à massa de íon expressa em gramas.
Exemplo:
Logo, ficamos com:
Quantidade de Matéria ou Quantidade em Mols (n)
Exemplo 1
Quantos mols de átomos correspondem a 280 g de ferro? (Fe = 56 u)
Resolução:
Quantos mols de moléculas correspondem a 88 g de dióxido de carbono (CO2)? (C = 12u, O = 16 u)
Resolução:
Concluímos, portanto, que estes cálculos podem ser generalizados pela fórmula:
Onde temos:
• n = quantidade em mols
• m = massa em gramas
• massa molar em gramas/mol
Classificação das reações químicas






sexta-feira, 19 de julho de 2013
Conteúdo de revisão para o simulado: Separação de misturas!!
Boa tarde pessoal. Conforme o combinado, segue hoje a aula sobre separação de misturas. Conteúdo este que irá auxiliá-los no estudo e revisão dos conteúdos para o simulado.
SEPARAÇÃO DE MISTURAS
SEPARAÇÃO DE MISTURAS
Na natureza, raramente encontramos substâncias puras. Em função disso, é necessário utilizarmos métodos de separação se quisermos obter uma determinada substância.
Para a separação dos componentes de uma mistura, ou seja, para a obtenção separada de cada uma das suas substâncias puras que deram origem à mistura, utilizamos um conjunto de processos físicos denominados análise imediata. Esses processos não alteram a composição das substâncias que formam uma dada mistura.
A escolha dos melhores métodos para a separação de misturas exige um conhecimento anterior de algumas das propriedades das substâncias presentes. Assim, se tivermos uma mistura de açúcar e areia, devemos saber que o açúcar se dissolve na água, enquanto a areia não se dissolve.
Muitas vezes, dependendo da complexidade da mistura, é necessário usar vários processos diferentes, numa sequência que se baseia nas propriedades das substâncias presentes na mistura.
01. SEPARAÇÃO DOS COMPONENTES DE MISTURAS HETEROGÊNEAS
I - SÓLIDO - SÓLIDO
a) Catação: usando a mão ou uma pinça, separam-se os componentes sólidos.
b) Ventilação: o sólido menos denso é separado por uma corrente de ar.
c) Levigação: o sólido menos denso é separado por uma corrente de água. A levigação é usada, por exemplo, para separar areia e ouro: a areia é menos densa e por isso, é arrastada pela água corrente; o ouro, por ser mais denso, permanece no fundo da bateia.
d) Separação magnética: um dos sólidos é atraído por um ímã. Esse processo é utilizado em larga escala para separar alguns minérios de ferro de suas impurezas.
e) Cristalização fracionada: todos os componentes da mistura são dissolvidos em um líquido que, em seguida, sofre evaporação provocando a cristalização separada de cada componente. A cristalização fracionada é usada, por exemplo, nas salinas para a obtenção de sais a partir da água do mar. A evaporação da água permite a cristalização de diferentes sais, sendo que o último a ser obtido é o cloreto de sódio (NaCl), usado na alimentação.
f) Dissolução fracionada: um dos componentes sólidos da mistura é dissolvido em um líquido. Por exemplo, a mistura sal + areia. Colocando-se a mistura em um recipiente com água, o sal irá se dissolver e a areia se depositar no fundo do recipiente, podendo agora ser separados pelos seguintes processos: a filtração separa a areia (fase sólida) da água salgada (fase líquida) e com a evaporação da água obteremos o sal.
g) Peneiração: usada para separar sólidos constituintes de partículas de dimensões diferentes. São usadas peneiras que tenham malhas diferentes. Industrialmente, usam-se conjuntos de peneiras superpostas que separam as diferentes granulações.
h) Fusão fracionada: Serve para separar sólidos, tomando por base seus diferentes pontos de fusão. Baseia-se, portanto, num aquecimento da mistura com controle da temperatura.
i) Sublimação: é usada quando um dos sólidos, por aquecimento, se sublima (passa para vapor), e o outro permanece sólido. Exemplo: sal e iodo ou areia e iodo (o iodo se sublima por aquecimento).
Obs.: As principais substâncias que podem ser separadas por sublimação são: o iodo, o enxofre e a naftalina (naftaleno).
II- SÓLIDO - LÍQUIDO
a) Decantação: a fase sólida, por ser mais densa, sedimenta-se, ou seja, deposita-se no fundo do recipiente
Obs.: a separação das duas fases pode ser feita de duas maneiras:
- vira-se lentamente a mistura em um outro frasco;
- com o auxílio de um sifão, transfere-se a fase líquida para um outro frasco (sifonação)
b) Centrifugação: é uma maneira de acelerar o processo de decantação, utilizando um aparelho denominado centrifuga. Na centrífuga, devido ao movimento de rotação, as partículas de maior densidade, por inércia , são arremessadas para o fundo do tubo.
c) Filtração simples: a fase sólida é separada com o auxílio de papéis de filtro. A preparação do café e o filtro de água são dois exemplos do uso da filtração no dia a dia.
d) Filtração à vácuo: O processo de filtração pode ser acelerado pela filtração à vácuo, onde uma trompa de vácuo "suga" o ar existente na parte interior do kitassato, o que permite um mais rápido escoamento do líquido. Observe o esquema ao lado.
III- LÍQUIDO - LÍQUIDO
Decantação: separam-se líquidos imiscíveis com densidades diferentes; o líquido mais denso acumula-se na parte inferior do sistema. Em laboratório usa-se o funil de bromo, também conhecido como funil de decantação, ou ainda, funil de separação. Num sistema formado por água e óleo, por exemplo, a água, por ser mais densa, localiza-se na parte inferior do funil e é escoada abrindo-se az torneira de modo controlado. A decantação pode ser feita de uma maneira mais rudimentar, utilizando-se um sifão (sifonação).
IV- GÁS - SÓLIDO
a) Decantação: a mistura passa através de obstáculos, em forma de zigue-zague, onde as partículas sólidas perdem velocidade e se depositam.
Industrialmente, esse processo é feito em equipamento denominado câmara de poeira ou chicana, conforme o esquema:
b) Filtração: A mistura passa através de um filtro, onde o sólido fica retido. Esse processo é muito utilizado nas indústrias, principalmente para evitar o lançamento de partículas sólidas na atmosfera. A filtração é também usada nos aspiradores de pó, onde o sólido é retido (poeira) à medida que o ar é aspirado.
02 . SEPARAÇÃO DOS COMPONENTES DE MISTURA HOMOGÊNEA
I- SÓLIDO - LÍQUIDO
Nas misturas homogêneas sólido-líquido (soluções), o componente sólido encontra-se totalmente dissolvido no líquido, o que impede as sua separação por filtração. A maneira mais comum de separar os componentes desse tipo de mistura está relacionada com as diferenças nos seus pontos de ebulição (PE). Isto pode ser feito de duas maneiras:
a) Evaporação: a mistura é deixada em repouso ou é aquecida até o líquido (componente mais volátil) sofra evaporação. Esse processo apresenta um inconveniente: a perda do componente líquido.
b) Destilação simples: a mistura é aquecida em uma aparelhagem apropriada, de tal maneira que o componente líquido inicialmente evapora e, a seguir, sofre condensação, sendo recolhido em outro frasco. Veja como é feita a destilação em laboratório:
Obs.: A entrada de água corrente no condensador deve ser feita pela parte inferior do aparelho para permitir que seu tubo externo esteja sempre completamente preenchido por água fria, que irá sair pela parte superior.
II - LIQUIDO - LÍQUIDO
a)Destilação fracionada: consiste no aquecimento da mistura de líquidos miscíveis (solução), cujos pontos de ebulição (PE) não sejam muito próximos. Os, líquidos são separados na medida em que cada um dos seus pontos de ebulição é atingido. Inicialmente, é separado o líquido com menor PE; depois, com PE intermediário e assim sucessivamente até o líquido de maior PE. A aparelhagem usada é a mesma de uma destilação simples, com o acréscimo de uma coluna de fracionamento ou retificação. Um dos tipos mais comuns de coluna de fracionamento apresenta no seu interior um grande número de bolinhas de vidro, em cuja superfície ocorre condensação dos vapores do líquido menos volátil, ou seja, de maior ponto de ebulição, que voltam para o balão. Enquanto isso, os vapores do líquido mais volátil atravessam a coluna e sofrem condensação fora dela, no próprio condensador, sendo recolhidos no frasco. Só depois de todo o líquido mais volátil ter sido recolhido é que o líquido menos volátil passará por evaporação e condensação.
Fonte: http://www.algosobre.com.br/quimica/separacao-de-misturas.html
Vídeo:
Qualquer dúvida só deixar nos comentários. =)
Obrigado e bons estudos!!
Marcadores:
catação,
centrifugação,
decantação,
destilação,
dissolução fracionada,
peneiração,
separação de misturas,
separação magnética,
ventilação
segunda-feira, 27 de maio de 2013
A seguir responda as questões abaixo
usando seu conhecimento sobre Lei da Cinética Química, molecularidade e
ordem de uma reação.
01)(PUC-SP)Considere a seguinte reação química:
N2(g) +2O2(g) > 2NO2(g) , em que a velocidade da reação obedece à equação : v = k.[N2].[O2]2. Triplicando a concentração (mol/L) de gás nitrogênio e duplicando a concentração (mol/L) de gás oxigênio ,e mantendo as demais condições constante ,nota-se que a velocidade da reação :
a) permanece constante.
b) triplica
c)aumenta seis vezes.
d) aumenta nove vezes.
e) aumenta doze vezes.
02)(FEI-SP) A reação 2NO(g) + Cl2(g) > 2NOCl(g) está se processando num recipiente fechado e em condições tais que sua velocidade obedece à equação : v = k.[NO]2.[Cl2]. Duplicando-se as concentrações molares do NO e do Cl2 , e mantendo todas as demais condições constante , nota-se que a velocidade da reação:
a) fica oito vezes maior.
b)fica dezesseis vezes maior.
c) quadruplica.
d) duplica.
e) permanece constante.
03)(PUC-SP) A reação
química hipotética 2 AB +CD2 > A2D + CD + B2 processa-se
segundo o mecanismo:
AB + CD2 > ADB + CD (etapa
lenta).
AB +
ADB > A2D+
B2( etapa rápida).
A lei de velocidade e a ordem total dessa reação são
respectivamente:
a)v = k.[AB]2.[CD2] ;3
b) v = k.[AB].[ADB] ;2
c) v = k.[AB][CD2]2 = 3
d) v = k.[AB][CD2] ;2
e) v = k.[AB]2 ;2
04)(PUC-SP) A poluição é uma das causas da destruição
da camada de ozônio.Uma das reações que podem ocorrer no poluído é a reação do
dióxido de nitrogênio com o ozônio.
>2NO2(g) + O3(g) N2O5(g) + O2(g)
Essa reação ocorre em duas etapas:
>I- 1NO2(g) + O3(g) NO3(g) + O2(g) ( lenta
).
>II- NO3(g) + NO2(g) N2O5(g) (rápida).
A lei da velocidade para a reação é:
a) v = k [ NO2]2.[ O3]
b) v = k [NO2].[ O3]
c) v = k [NO3].[NO2]
d) v = k [ NO3]2
e) v = k [NO2].[ O3]+k’[NO3].[NO2]
>05)(FEI-SP) Considere
as seguinte reação química: 1N2(g) + 2O2(g)
2NO2(g) em que a equação da velocidade é expressa por : v =
k.[N2] .[O2]2 O valor total das
afirmações corretas será de:
01- Ao duplicarmos a concentração de O2 , a velocidade
da reação torna-se quatro vezes maior.
02-A reação fica duas vezes mais rápida se duplicarmos a concentração de
N2.
04-As velocidades ficam inalteradas se variarmos igualmente as
concentrações de N2 e O2.
08-Ao duplicarmos a concentração de O2 e reduzirmos à
metade a concentração de N2 ,a velocidade da reação torna-se
duas vezes maior.
16-A velocidade da reação depende só da temperatura.
a) 7
b) 21
c) 11
d) 13
e) 30
06)(FEI-SP) A amônia (NH3) é de grande importância na fabricação
de fertilizantes.Ela pode ser obtida a partir de hidrogênio (H2) e
nitrogênio(N2) .A lei de velocidade para essa reação é: v = k.[H2]3.[N2]
. Quando a concentração de hidrogênio é duplicada e a concentração de
nitrogênio é triplicada , mantendo-se constante a temperatura ,é correto afirmar
que:
a) a velocidade final não é alterada.
b) a velocidade final é de 24 vezes a velocidade inicial.
c) a velocidade final é de 06 vezes a velocidade inicial.
d) a velocidade final é de 18 vezes a velocidade inicial.
e) a velocidade final é de 54 vezes a velocidade inicial.
07)(UFSC) A tabela abaixo mostra as velocidades iníciais da reação em
função das concentrações dos reagentes X e Y .
Veja :
[X]
[Y] Velocidade inicial
0,1
0,1 0,3
0,2
0,1 0,6
0,2
0,2 2,4
Pergunta-se: Qual será a expressão da velocidade?
08)(FUVEST-SP) A cinética da reação: 2
HgCl2 + C2O4-2 > 2Cl-1 + 2 CO2(g) + Hg2Cl2(s)
foi estudada em soluçãoaquosa, segundo a quantidade de matéria de Hg2Cl2 que
precipita por litro de solução por minuto.Os dados obtidos estão na
tabela abaixo:
[
HgCl2] [ C2O4-2]
Velocidade
mol/L-1
mol/L-1
mol/L-1x min-1
0,100
0,15
1,8X10-5
0,100
0,30
7,2X10-5
0,050
0,30
3,6X10-5
Baseando-se nessas informações, responda:
a) Qual deverá ser a equação da velocidade da reação?
b) Qual deverá ser o valor da constante da velocidade da reação?
c) Qual deverá ser o valor da velocidade da reação quando [HgCl2]
e [C2O4-2] possuem 0,010M para ambas
concentrações.
09)(PUC-SP) A equação X
+ 2Y > XY2 representa uma reação cuja
equação da velocidade é:v = k [X]. [Y]. Assinale o valor da
constante de velocidade, para reação acima,sabendo que ,quando a concentração
de X é 2,5X10-3 M e a concentração de Y é 0,005X107 ,a
velocidade da reação é de 3X10 2 mol/L x min:
a) 3,0
b)1,5
c) 2,4
d) 0,75
e) 0,5
10)(UFSC) No estudo da cinética da
reação: 2NO(g) +H2(g) > N2O(g)
+ H2O(g) á temperatura de 700ºC ,foram obtidos os dados
constantes da tabela abaixo:
[ ] inicial
(mol/L) V0 (
velocidade inicial) mol/ L-1x s-1
NO H2
0,025
0,01
2,4x10-6
0,025
0,005 1,2x10-6
0,0125
0,01
0,6x10-6
Determine:
a) A ordem global da reação.
b) Constante de velocidade nessa temperatura.
11)(FUVEST-SP) Uma mistura gasosa ideal de propano e ar é queimada a
pressão constante, gerando 720L de CO2 por hora, medidos a
20ºC.Sabe-se que o propano e oar encontram-se em proporção estequiométrica.
Determine a velocidade média de reação da mistura em relação ao ar,considerando
a composição do ar 21% de O2 e 79% de N2 ,em
volume. (Dados: M.A . O = 16g /mol-1 , N = 14 g/mol-1).
12)(FEI-SP) Na seguinte reação de
decomposição do clorato de potássio: 2 KClO3 > 2KCl + 3O2 Verifica-se que em 40 segundo formaram-se 2,24
litros de O2 medidos nas CNTP.Calcule a velocidade média de
formação de O2,expressa em :
a) Litros/segundo a
CNTP
b) Gramas/segundo. Obs: CNTP: 22,4L
13)(UNICAMP-SP) para uma dada reação
química ,expressa com A > B
,sabe-se que a concentração de A reduz-se à metade em cada intervalo de
30minutos. Responda:
a) Se a concentração inicial de A for de 1,00 mol/L , após quanto tempo
ele atingirá o valor 0,125 mol /L?
b) E a velocidade dessa reação é constante,aumenta ou diminui com o
tempo? Justifique.
14) (FUVEST-SP) Atabela abaixo mostra valores da velocidade inicial de
reação para várias concentrações molares dos reagentes A,B e C. Veja:
|
[A]
|
[B]
|
[C]
|
Velocidade (moL-1x L-1x min-1
|
|
0,4
|
0,4
|
0,4
|
0,02
|
|
0,4
|
0,4
|
0,8
|
0,02
|
|
0,4
|
0,8
|
0,4
|
0,04
|
|
0,8
|
0,4
|
0,4
|
0,08
|
Observando a tabela acima responda as seguintes perguntas:
a)Qual será a equação da velocidade?
b)Qual a ordem da reação para o reagente A ? e
para C ?
c)Justifique a ordem para o reagente C ?
d)Qual a constante de velocidade para o exercício
acima?
15)(PUC-SP) Um
analista, efetuando medidas da quantidade de matéria em mols da substância H2 para
a reação de formação do NH3 obteve,em função do tempo,a
seguinte tabela. N2(g) + 3H2(g) > 2NH3(g)
TEMPO (min ) Quantidade
de matéria de H2 existente (mol)
0 .................... 20,0
5..................... 10,0
15.....................
2,5
Qual será a velocidade média da reação nos intervalos de:
a) 0 a 5
min
b) 5 a 15min ?
Assinar:
Postagens (Atom)












